电子转移 ( )若以下方程式中KMnO4,HCI2各是1mol,那么序号(1)与(2)各转移多少电子?{请写过程}1.· 2KCLO3==2kCl+3O22·.2KMnO4+16HCI===2KCI+2MnCI2+8H2O+5CI2
来源:学生作业帮助网 编辑:作业帮 时间:2024/04/29 07:31:32
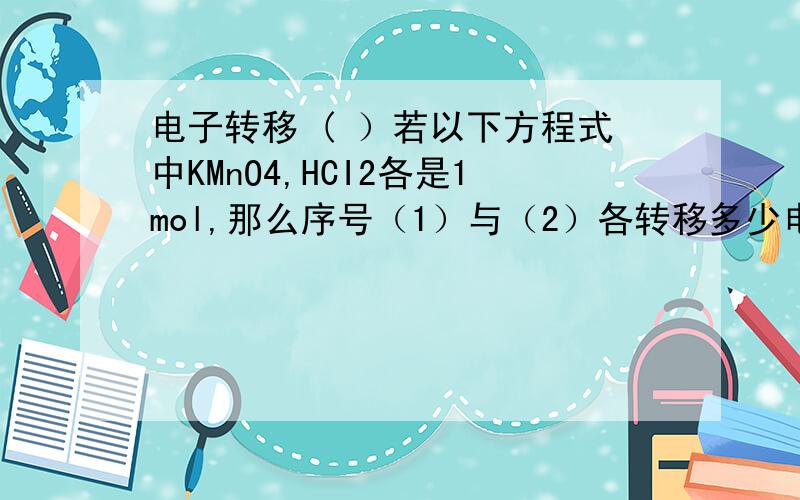
电子转移 ( )若以下方程式中KMnO4,HCI2各是1mol,那么序号(1)与(2)各转移多少电子?{请写过程}1.· 2KCLO3==2kCl+3O22·.2KMnO4+16HCI===2KCI+2MnCI2+8H2O+5CI2
电子转移 ( )
若以下方程式中KMnO4,HCI2各是1mol,那么序号(1)与(2)各转移多少电子?{请写过程}
1.· 2KCLO3==2kCl+3O2
2·.2KMnO4+16HCI===2KCI+2MnCI2+8H2O+5CI2
电子转移 ( )若以下方程式中KMnO4,HCI2各是1mol,那么序号(1)与(2)各转移多少电子?{请写过程}1.· 2KCLO3==2kCl+3O22·.2KMnO4+16HCI===2KCI+2MnCI2+8H2O+5CI2
判断电子的转移,既可以从氧化剂以及形成的还原产物考虑,也可以从还原剂及其形成的氧化产物的化合价变化来考虑.最好看具体的方程式,怎么样方便就先考虑哪一个.
比如,你给出的第一个方程式,就先考虑氧元素的化合价变化比较好,因为氧元素的化合价变化较少,单质时为0价,化合物中一般为-2价,因此从氧化产物3个O2可知,O失去的电子为2X6=12个,即这12个电子从O元素这里转移到了CL元素这里.
再比如说,你给出的第二个方程,KMnO4中Mn元素的化合价为+7价,而MnCI2中Mn元素的化合价为+2价,还原产物为2个MnCI2,因此Mn元素得到的电子数为5X2=10,根据电子得失守恒原理可知,Mn元素得到的10个电子即为HCI中的Cl元素所失去的10个电子,即从氯元素中转移了10个电子给Mn元素.
那个HCl2 是什么东西?
2KCLO3==2kCl+3O2
Cl从+5降低-1,降低6价,有2个+5价Cl化合价变化,所以转移电子数=6*2=12
1mol按系数比例算下就行
2KMnO4+16HCI===2KCI+2MnCI2+8H2O+5CI2
Mn从+7价降低到+2价,降低5价,有2个+7价的Mn化合价降低,所以转移电子数=5*2=10
如果用Cl去判断...
全部展开
2KCLO3==2kCl+3O2
Cl从+5降低-1,降低6价,有2个+5价Cl化合价变化,所以转移电子数=6*2=12
1mol按系数比例算下就行
2KMnO4+16HCI===2KCI+2MnCI2+8H2O+5CI2
Mn从+7价降低到+2价,降低5价,有2个+7价的Mn化合价降低,所以转移电子数=5*2=10
如果用Cl去判断,化合价变化的Cl是10个。
收起
写出离子方程式简单
1,6mol
2,8mol
KCLO3中CI为+5价,KCI中CI为-1价,因此1 摩尔的KCLO3转移6摩尔的电子
KMnO4中Mn为+7价,MnCI2内为+2价,因此转移5 摩尔电子。